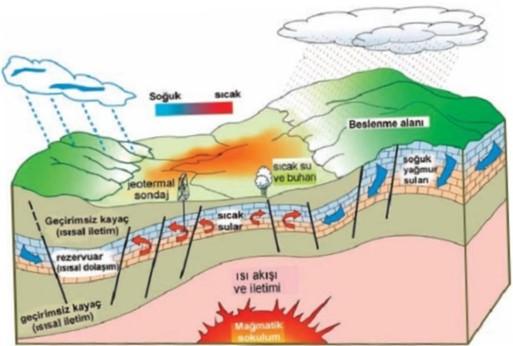
Jeotermal kaynak, yerkürenin çeşitli derinliklerinde birikmiş halde bulunan ısının oluşturmuş olduğu, sıcaklık değerleri devamlı olarak bölgedeki atmosferik ortalama sıcaklık değerinin üzerinde olan ve çevresindeki normal yerüstü ve yeraltı sularına göre daha fazla çeşitli mineral, tuz ve gaz ihtiva edebilen sıcak su ve buhar olarak tanımlanmaktadır. Jeotermal enerji ise bu kaynaklardan elde edilen dolaylı veya doğrudan her türlü yararlanmayı kapsamaktadır. Şekil 1’de oluşum modeli gösterilen bir jeotermal sistemi meydana getiren parametreler şöyledir; yerkürenin derinliklerinde yer alan ısı kaynağı, ısıyı taşıyan akışkan, akışkanı bünyesinde bulunduran rezervuar kayaç ve ısı kaybını engelleyen örtü kayaçtır.
Dünyanın merkezinde sıcaklığı yaklaşık 4200°C olan ve magma adı verilen ergiyik kütle bulunmaktadır. Tektonik hareketlerin neden olduğu kırık ve zayıf bölgelerden kabuk bünyesinde sığ derinliklere veya yeryüzüne kadar ulaşan magma faaliyetleri, jeotermal sistemin ısı kaynağını oluşturmaktadır. Yeryüzünün kırık ve çatlak olan kısımlarından süzülen meteorik sular, derinliklerde ısınmasının ardından gözenekli ve geçirimli olan rezervuar kayaç içerisinde birikmektedir. Bu suların bir kısmı fay hatları boyunca yükselerek jeotermal kaynakları meydana getirmektedir. Üzeri geçirimsiz bir örtü kaya ile kapanmış ve çoğunlukla yeryüzüne ulaşamayan rezervuar kaya bünyesindeki jeotermal akışkan, sondaj çalışmalarıyla yüzeye çıkartılmaktadır. Jeotermal kaynaklar, enerji potansiyeli ve içermiş oldukları mineraller göz önüne alınarak elektrik üretimi, ısıtma veya kurutma gibi proseslerde değerlendirilmektedir.
Kullanım Alanları
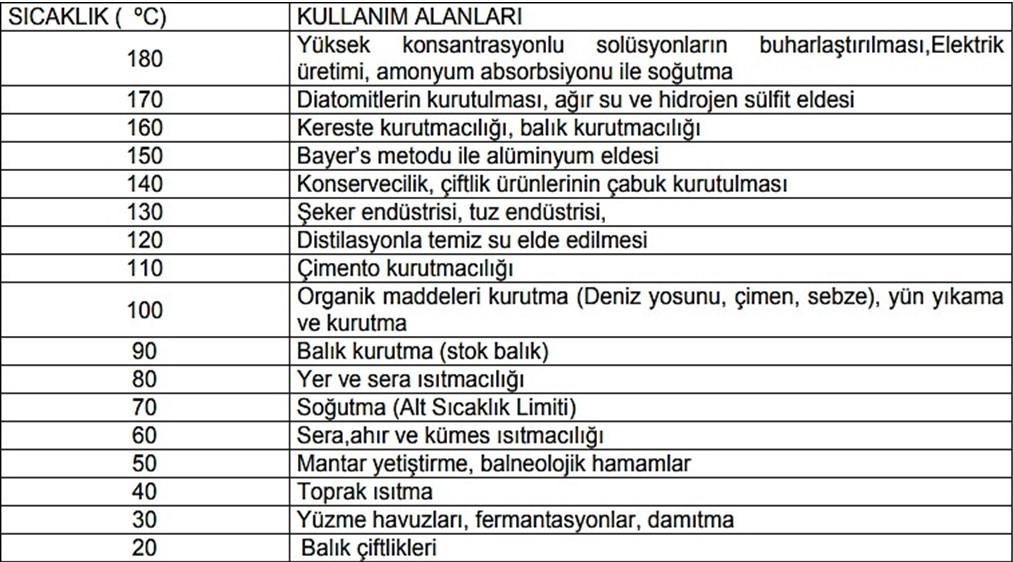
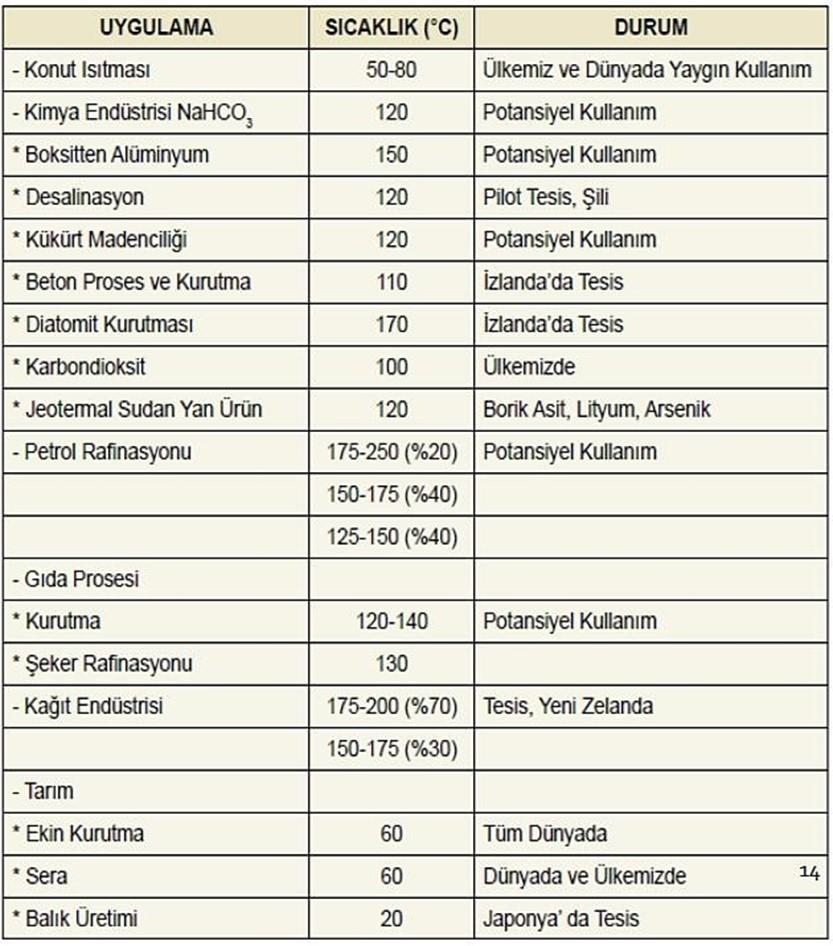
Jeotermal enerji, sıcaklığına bağlı olarak, başta elektrik üretimi, ısıtma ve tedavi amaçlı olmak üzere endüstride çeşitli alanlarda kullanılmaktadır. Yüksek sıcaklıkta bir jeotermal akışkandan entegre olarak birçok alanda faydalanmak mümkündür. Tablo 1’de daha ayrıntılı olarak gösterilmiştir.
Ülkemizde Jeotermal Enerji
Türkiye tektonik hareketlerin yoğun olduğu bir coğrafyada bulunmaktadır. Ülkemizin her tarafında yayılmış, doğal çıkış şeklinde ve değişik sıcaklıklarda birçok jeotermal kaynak mevcuttur. Bu sebepten ötürü jeotermal enerji ülkemiz için önemli bir yenilenebilir enerji kaynağıdır. [1]
Akışkan sıcaklıklarına göre jeotermal enerji kaynakları üç sınıfa ayrılmaktadır:
- Düşük entalpili sahalar (20 – 70°C sıcaklık)
- Orta entalpili sahalar (70 – 180°C sıcaklık)
- Yüksek entalpili sahalar (>180°C sıcaklık)
Türkiye’de jeotermal enerji tespitine ve bu enerjinin kullanımına dönük çalışmalar özellikle İzmir ve Ege Bölgesi’nin bazı diğer noktalarında ilerlemiştir. İzmir’in Balçova ve Narlıdere ilçelerinde halen yaklaşık 15 bin konut jeotermal enerji ile ısıtılmaktadır. Seferihisar, Dikili, Bergama, Çeşme, Aliağa, Urla, Güzelbahçe, Bayındır, Menderes, Kemalpaşa ve Kozaklı ilçelerinde de varlığı bilinen jeotermal kaynaklarının kullanılması halinde, sadece İzmir Büyükşehir Belediyesi sınırları içinde 220 bin konutu ısıtabilecek kapasiteye ulaşılabileceği hesaplanmaktadır. Ancak atılan adımlar (İzmir Jeotermal A.Ş. gibi) doğalgaz dağıtım çalışmalarına kıyasla daha yavaş yürümekte, resmi enerji politikalarının zorlayıcı etki yaratan düzenlemeleri de devreye girdiğinde, jeotermal enerji altyapı çalışmalarını caydırıcı unsurlar giderek belirginleşmektedir. Dış etkenlere bağımlılıkla eşdeğer doğalgaz kullanımını asgariye indirerek, teknolojisi ve insan kaynakları halihazırda mevcut yerli jeotermal enerjinin ön plana çıkarılmasına yönelik çabalar pek çok ilgili çevre tarafından ısrarla sürdürülmektedir. Bu bağlamda, yıllardır Jeotermal Yasası (Teklif) çıkarılmasına uğraşılmış ve bu yasa yönetmeliği ile birlikte 13.06.2008 tarihinde yürürlüğe girmiştir. Diğer ülkelere oranla daha şanslı bir konumda olan Türkiye’nin jeotermal potansiyeli gelişen jeofizik yöntemlerle ortaya çıkarılmış olacaktır.
Türkiye’de çalışmakta olan toplam 32 adet jeotermal enerji santrali bulunur. Santrallerin kurulu olduğu iller ve santral sayıları şöyledir: Aydın (20), Denizli (5), Manisa (5), Çanakkale (2). Ayrıca; Aydın’da (4), Manisa’da (2), Denizli’de (1) adet jeotermal santral kurma çalışmaları devam etmektedir. 820,86 MW kurulu gücündeki santraller Türkiye’nin toplam kurulu gücünün %1,58’ini oluşturur.
Türkiye’ de Jeotermal Enerji Üretilebilecek Alanlar: [5]
| Germencik, Aydın 232 °CKızıldere, Buharkent, Aydın 242 °CKurudere, Alaşehir, Manisa 184 °CGöbekli, Alaşehir, Manisa 182 °CTuzla, Çanakkale 174 °CSalavatlı, Aydın 171 °C | Simav, Kütahya 162 °CSeferihisar, İzmir 153 °CCaferbey, Salihli, Manisa 150 °CYılmazköy, Aydın 142 °CBalçova, İzmir 136 °CDikili, İzmir 130 °C |
Türkiye dünyanın 7. büyük jeotermal enerji potansiyeline sahip ülkedir. Ülkemizin jeotermal enerji potansiyelini belirlemek amacıyla Maden Tetkik ve Arama Genel Müdürlüğü 1962 yılında çalışmalara başlamıştır. Günümüze kadar MTA tarafından 227 adet jeotermal bölge keşfedilmiş, doğrudan kullanım ve elektrik üretimi amaçlı 550 tanesi MTA tarafından olmak üzere toplamda yaklaşık 1100 adet jeotermal sondaj kuyusu açılmıştır. Türkiye’nin teorik jeotermal enerji potansiyeli 31.500 ile 60.000 MWt (megawatt ısı) arasında tahmin edilmekte olup fiili kullanılabilir teknik kapasitesi ise 4809 MWt olarak hesaplanmaktadır. Bugüne kadar öngörülen teknik kapasitenin 2880 MWt’lik bir kısmı kanıtlanmıştır.
Ülkemizde sıcaklıkları 20-242 arasında değişen 1500 adet sıcak ve mineralli su kaynğı mevcuttur. Günümüz itibarıyla Türkiye’de;
- 90.000 konut eşdeğeri bina
- 3.000.000 m2 sera
- 400 spa tesisi
jeotermal enerjiyle ısıtılmaktadır. [1]
Ülkemizde yer alan Jeotermal Enerji Santralleri Tablo 2’de gösterilmiştir. Belirtildiği gibi en çok yatırım alan il Aydın’dır. Burada yer alan sıralama Santral gücüne göre sıralanmıştır. Ülkemizin ihtiyacı olan elektirik üretiminin bir kısmı bu santral sayesinde karşılanmaktadır.
Tablo 2: Türkiye’de Yer Alan Jeotermal Enerji Santralleri
| No | Santral Adı | İl | Firma Adı | Kurulu Güç (MWe) | Santral Tipi |
| 1 | Efeler | Aydın | Güriş Holding | 115 | Binary |
| 2 | Kızıldere 2 | Denizli | Zorlu Enerji | 80 | Binary+Flash |
| 3 | Pamukören | Aydın | Çelikler Enerji | 68 | Binary |
| 4 | Mis 3 JES | Manisa | Soyak Enerji | 48 | Binary |
| 5 | Maren | Aydın | Kibaş Holding Grubu | 44 | Binary |
| 6 | Dora 3 | Aydın | BM Holding | 34 | Binary |
| 7 | Ala 2 | Manisa | Maspo Enerji | 30 | Binary |
| 8 | Greenco | Denizli | Greeneco Enerji | 26 | Binary |
| 9 | Enerjeo | Manisa | Enerjeo Kemaliye Enerji Üretim | 25 | Binary |
| 10 | Kubilay | Aydın | Çevik Grup | 24 | Binary |
| 11 | Türkerler Alaşehir | Manisa | Türkerler Holding | 24 | Binary |
| 12 | Özmen 1 | Manisa | Özmen Holding, Sis Enerji | 24 | Binary |
| 13 | Kuyucak | Aydın | Turcas Enerji | 18 | Binary |
| 14 | 3S Kale | Aydın | 3S Kale Enerji | 17 | Binary |
| 15 | Buharkent | Aydın | Limgaz Elektrik Üretim | 14 | Binary |
| 16 | Gümüşköy | Aydın | BM Holding Enerji Grubu | 13 | Binary |
| 17 | İDA | Çanakkale | Yerka Elektrik Üretim A.Ş. | 12 | Binary |
| 18 | RSC Seferihisar | İzmir | RSC Elektrik | 12 | Binary |
| 19 | Karkey Umurlu | Aydın | Karadeniz Enerji | 12 | Binary |
| 20 | Maspo Enerji JES 4 | Aydın | Gürmen Group, Maspo Enerji | 10 | Binary |
| 21 | Babadere | Çanakkale | MTN Enerji | 8 | Binary |
| 22 | Tuzla | Çanakkale | Enda Enerji | 7,5 | Binary |
| 23 | Kızıldere | Denizli | Aydem Enerji | 6,85 | Binary |
| 24 | Bereket | Denizli | Bereket Enerji | 6,85 | Binary |
| 25 | Tosunlar | Denizli | Akça Enerji | 3,81 | Binary |
Jeotermal Enerji Üretiminde Karşılanan Sorunlar ve Çözümleri
Kabuklaşma
Ülkemizde bulunan jeotermal sahalar sıvı ağırlıklı sistemlerdir. Bu tür sıvılar ısının alınmasını kolaylaştırmak bakımından bir avantaj olmakla birlikte akışkanın içerdiği silis ve kalsiyum elementleri yüksek sıcaklıklı sahalarda kabuklaşma ve korozyona neden olur.
Kabuklaşma, jeotermal sahaların işletilmesinde karşılaşılan en önemli sorunlardan biridir. Rezervuar koşullarında genellikle, yeraltı sıcak sular ihtiva ettiği erimiş maddelerle denge halindedir. Gazlaşma, buharlaşma ve soğumaya bağlı olarak ortaya çıkan kabuklaşmanın ana nedeni CaCO3 gibi karbonatlı bileşiklerin göreceli çözünmezlikleridir. Üretim esnasında CO2 ayrışımı sonucunda meydana gelen pH yükselimi ve buna bağlı olarak karbonik asidin önce bikarbonat, daha sonra karbonat iyonlarına dönüşümü ile birlikte meydana gelen gazlaşma veya buharlaşma olayları, doğal halde mineralleriyle denge halinde bulunan jeotermal akışkanda dengesizliğe sebep olmaktadır. Bu dengesizlik, aşırı doygunluğa varan Ca++, Mg++, Sr++, CO – ve SO – gibi iyon çiftlerinin birbirleriyle bileşik oluşturarak çökelmeler oluşturmasına sebep olur. Önlem alınmadığı takdirde, üretim-reenjeksiyon donanımları boyunca sürekli akan aşırı doymuş akışkan içerisindeki kalsiyum karbonat kristalleri büyüyerek ve uygun koşullar bulduğunda donanım yüzeylerine tutunarak sert tabakalı kabuklar oluşturur.
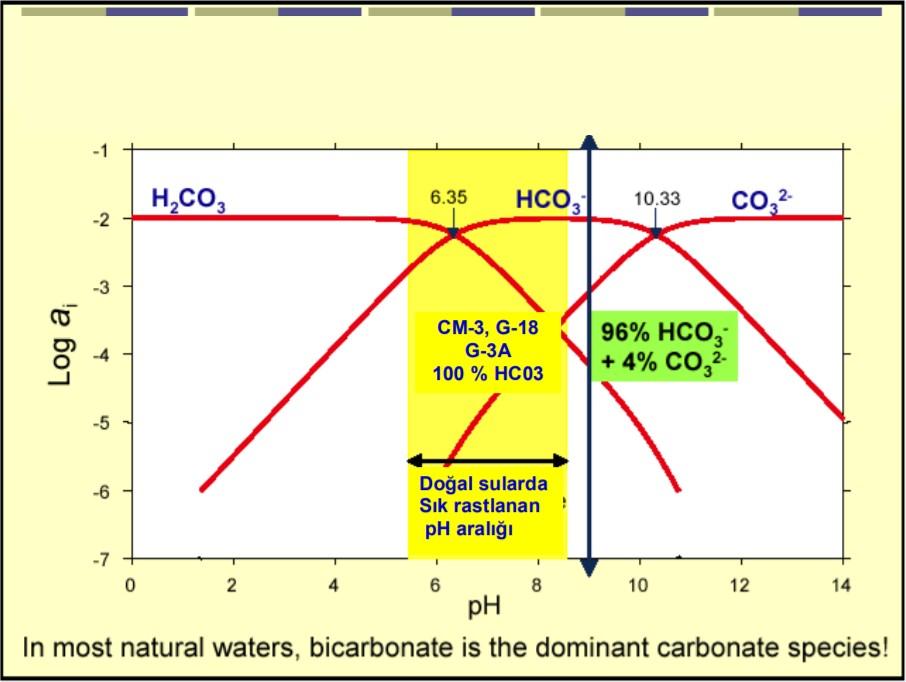
Genelde termal suların üretim ve kullanımlarında üç ayrı özelliklerde kabuk oluşumları ile karşılaşılır. Oluşturdukları kimyasal kompozisyona göre bu kabuklaşma çeşidi kaba hatları ile şöylece özetlenebilir: a) Silis ve silikatlardan ileri gelen kabuklaşma b) Karbonat kabuklaşmaları c) Sülfat ve sülfitlerin oluşturduğu kabuklaşmalar Ülkemizde bulunan jeotermal sahaların çoğunda olduğu gibi, elektrik üretimi amaçlı kullanılmakta olan Kızıldere, Germencik ve Salavatlı jeotermal sahalarında karşılaşılan kabuklaşma tipi karbonat kabuklaşmasıdır. Hidrotermal sistemlerin çoğu çok miktarda çözünmüş CO2 içerirler. Suda çözünmüş halde bulunan CO2 miktarı, suyla temas halinde bulunan gaz fazındaki CO2‟in kısmi basıncı ile doğru orantılıdır (Henry Kanunu). Kabuklaşma üzerinde büyük bir role sahip karbon dioksitin kökeninin önemi yoktur. Volkanik ya da karbonatların parçalanması sonucu yeraltı sularının yapısına girmiş olabilir. Kökeni ne olursa olsun CaCO3 kabuklaşmasının oluşumu üzerinde son derece etkilidir. Türkiye jeotermal sahalarının çoğunda oluşan kalsiyum karbonat kabuklaşmaları akışkan içinde bulunan Ca++ ve Mg++ iyonları ile CO–3 iyonlarının uygun pH ortamında birbirleri ile aşağıdaki reaksiyonlar gereğince çözünürlüğü az bileşikler (CaCO3, MgCO3, SrCO3 v.b.) oluşturması sonucu meydana gelmektedir:
CO2 (Aq) <=> CO2 (vap) ……………………. (1)
HCO – + H+ <=> CO (Aq) +H O ……………………. (2)
2HCO3- <=> CO2 (Aq) +CO3-2+ H2O………………………………….. (3)
Ca++ + CO -2 <=> CaCO……………………………………………………………………. (4)
[(3) + (4)] Ca++ 2HCO – <=> CaCO + CO + H O
HCO3 – + H3BO3 <=> H2BO – + CO2 (Aq) +H2O……………………………………… (5)
HCO3 -+ H4SiO4 <=> H3SiO4 – + CO2 (Aq) +H2O…………………………………………… (6)
Jeotermal uygulamalarda kalsiyum karbonat kabuklaşmalarını tetikleyen faktörler yukarıda açıklanan kimyasal tepkimelerin çift yönde (reversible) akışını etkileyen faktörlerdir. Bu faktörlerin başında pH, CO2 kısmi basıncı (PCO2) ve total tuz konsantrasyonlarıdır. Aluminosilikat minerallerinin pH dengesi üzerindeki etkisi büyüktür. Şekil 2’de görüldüğü gibi derinliklerde basınç altında suda çözünmüş halde bulunan CO2, karbonik asit oluşturarak (H2CO3) akışkana asidik yapı kazandırmaktadır. Henry kanuna göre, suda çözünen CO2 miktarı, kısmi basıncıyla doğru orantılı olup, çözeltinin pH‟ı üzerinde çok etkin bir parametredir. Çözeltinin içerisinde çözünmüş halde kaldığı sürece, çözeltinin pH‟ı düşüktür. Sıvı fazdan gaz fazına geçmeye başlayınca (gas breakout), akışkanın pH‟ ı yükselmeye başlamakta (3) ve (4) nolu eşitliklerle çözeltide önce HCO3 -, sonra CO -2 iyonları çoğalmaya başlamaktadır. Ortamda çoğalmaya başlayan CO -2 iyonları çözeltide bulunan Ca+2 iyonları ile birleşerek karbonat kabuklaşmasına neden olmaktadır.
Kabuklaşma Önleme Yöntemleri
Karbonat kabuklaşmaları kontrol altına alınma yöntemleri şu şekilde sıralanabilir:
- Karbonat-bikarbonat dengesini pH ve CO2 kısmi basıncı ile ayarlamak,
- Oluşan kabuğu peryodik olarak asit ya da matkapla temizlemek,
- Uygun bir inhibitörle kabuk oluşumunu engellemek,
- Dalgıç pompa kullanarak basınç düşüşünü ve dolayısıyla kabuk oluşumunu engellemek
Kabuklaşmanın önlenmesi veya geciktirilmesi için kullanılan bütün metotlar şüphesiz birinci derecede önemlidir. Ancak CO2 kısmi basıncı ile pH ayarlamaları, üretimin kısıtlamasını gerektirdiği, mekanik temizleme de üretimde sürekliliği kesintiye uğrattığından, saha için uygun yöntemler değildir. Kabuklaşma hızı jeotermal akışkanların karbon dioksit içerikleri ile doğru orantılıdır. Karbon dioksit konsantrasyonunun düşük olduğu ülkemiz jeotermal sahalarında kabuklaşma hızı yavaştır. Böyle sahalarda karbon dioksitin kısmi basıncı üzerinde ayarlamalar yaparak kabuklaşmayı önleme olası değildir. Kabuklaşma problemini teknik ve ekonomik olarak uygun bir inhibitörle ile gidermek, en uygun yoldur. İnhibitör uygulamalarında saha Jeokimyasal yapısına uygun inhibitör seçimi yapabilmek için, sahanın bütün bölümlerini temsilen değişik derinlik, değişik sıcaklık ve değişik gaz içerikli kuyularında birer haftalık süreyle inhibitör testleri gerçekleştirilmelidir. Yapılan inhibitör testlerinin amacı değişik fiziksel ve kimyasal özellikler arz eden saha kuyularına en uygun inhibitörü en uygun dozajda verebilme koşullarını araştırıp bulmaktır. Yapılan testlere göre inhibitör basımında kullanılacak pompa 1/5 seyreltme oranında yaklaşık 300 ton/h debili kuyulara 8–9 ppm dozajlama yapabilme kapasitesine sahip olmalıdır. Bu da pompanın en az, 10 bar karşı basınca 18 litre sıvı basma kapasitesine sahip olmasını gerektirir.
- CO2 Kısmi Basınç Kontrolü
Kısmi basınç kontrolü düşük sıcaklıklı su üreten kuyularda dalgıç pompa kullanılarak sağlanabilir. Söz konusu pompa vasıtasıyla kuyuda basınç düşüşü engellenerek, CO2’nin sıvı fazdan gaz fazına geçişi ve bundan kaynaklanan CaCO3 çökelmesi önemli derecede önlenmiş olur. CO2 kısmi basıncı ‘’Equilibrium Flash System (EFP)’’ diye adlandırılan sistem ile de sağlanabilir. Bunun için, kuyuda gaz ayrışım noktasının altına daimi olarak CO2 enjekte etmek yeterlidir. Flash Sistemi Türkiye’de yaygın kullanılan bir sitem değildir. Yüksek basınç sağlayan jeotermal sahalarda, yüksek kuyu baş basıncı ile üretim yapmak kuyu içinde kabuklaşmayı belli bir dereceye kadar önler. Örneğin, Kızıldere ve Germencik jeotermal sahalarında 15 bar ve daha yüksek kuyu başı basınçları ile üretim, kuyu içinde kabuklaşma hızını minimum düzeye indirmektedir. Ancak yüksek WHP üretim kısıtlaması anlamına geldiğinden tercih edilen üretim şekli değildir. Üretim miktarı ile kuyu başı basınçları ters orantılıdır.
- pH Ayarlaması
Jeotermal akışkanların kimyasal kompozisyonlarının ve özellikle pH’larının ayarlanması, çökelme yapmalarını önemli derecede önler. Bunun için akışkana yeterli miktarda HCl katkısı yapılması gerekir. Bu yöntem teknik olarak yeterli olsa da ekonomik değildir. Zira 1 litre akışkanın çökelme yapmasını engellemek için 200 ml HCl ilavesi gerekebilir.
- İnhibitör (Kimyasal madde) Enjeksiyonu
Kimyasal bir inhibitörle kalsiyum karbonat kabuklaşmalarını önlemek teknik ve ekonomik olarak en iyi yoldur. Bu yöntemde en önemli noktalar akışkanın özelliklerine en uygun inhibitörü araştırıp bulmak ve kuyularda gerekli derinliklere enjekte etmektir. Düşük sıcaklıklı sahalardaki kuyulara inhibitörle kabuklaşmayı önleme yöntemini uygulamak kolaydır. Fakat yüksek sıcaklıklı sahalardaki kuyulara bu yöntemin uygulanması hem inhibitör seçimi ve hem de mekanik zorluklar bakımından biraz zordur. Türkiye jeotermal sahalarında ilk inhibitör denemesi Kızıldere KD-1A kuyusunda gerçekleştirilmiştir. Elektrik üretiminde kullanılan Kızıldere, Germencik, Salavatlı sahalarında inhibitörle kabuklaşmayı önleme yöntemi başarı ile uygulanmaktadır. Piyasada bulunan kabuklaşma inhibitörlerinin kökenleri 5 ana kimyasal grup altında toplanabilir:
- Aminofosfonatlar
- Amino alkol fosfat eterleri
- Sodyum poliakrilat polimerler
- Polikarboksilik asit
- Organikfosfatlar
Kabuklaşmada kullanılan bütün etkili inhibitörler yukarıda sıralanan 5 ana grup kimyasaldan türetilmektedir. Bu inhibitörlerin kabuklaşmayı önleme mekanizmaları birbirinden farklıdır. Fosfat ve fosfonat kökler bileşik oluşturmak ve eşik (threshold) görevi yaparak, akrilat köklü olanlar kristal büyümesini önleyerek ve amino gruplu olanlar metal yüzeyi üzerinde film oluşturarak kabuklaşmayı önlerler.
Korozyon
Jeotermal üretim ve uygulamalarda bütün korozyon çeşitlerin rastlamak mümkündür. Çünkü jeotermal akışkanlar, korozyona sebep olabilen bütün iyon ve bileşikleri içerirler. Jeotermal akışkanlarda bulunup korozyon etkisi yaratan iyon ve bileşiklerin başında erimiş oksijen (O2), karbon dioksit (CO2), hidrojen iyonu (H+), klor iyonu (Cl–), hidrojen sülfür (H2S), amonyum bileşikleri (NH4 +) ve sülfat iyonları (SO -2) gelmektedir. Her türlü korozyona mukavim materyalden yapılmış boru ve jeotermal uygulamalarda kullanılan aygıtlar bulmak mümkün değildir. Paslanmaz çelik, AISI 304 ve AISI 316 malzemelerinin jeotermal akışkandan ileri gelen korozyon çeşitlerine mukavim oldukları bilinmektedir. Plastik malzemeler her türlü korozyona çaredir. Ancak maalesef jeotermal kullanımlarda karşılaşılan yüksek sıcaklık ve yüksek basınç şartlarına uygun değildir. Bu yüzden jeotermal uygulamalarda kullanılan çelik malzemeleri korozyondan korumak için kabuklaşma inhibitörü ile birlikte korozyon inhibitörü kullanılmasında fayda vardır.
Korozyonu Önleme İşlemi
Piyasada hem kabuklaşma hem de korozyonu önleyen inhibitör kombinasyonları mevcuttur. Belli bir ortam içinde bulunan bir metalik sistemin korozyonunu önlemek veya korozyon hızını azaltmak üzere alınacak önlemler üç ana grup altında toplanabilir:
- Elektrokimyasal yöntemler
- Katodik koruma
- Anodik koruma
- Kimyasal yöntemler
- İnhibitör kullanımı
- Ortamın kimyasal bileşiminin değiştirilmesi
- Boya ile koruyucu kaplama
En çok kullanılan elektrokimyasal yöntem katodik korumadır. Bu yöntemle korozyona uğrayan yapının potansiyeli kontrol edilerek, metal termodinamik olarak stabil hale getirilebilir. Koruyucu kaplamalar özellikle organik boyalar korozyonu önlemek amacıyla kullanılan en basit ve en ucuz yöntemdir.
Korozyon inhibitörü olarak kullanılan başlıca kök kimyasal maddeler kısa şöylece özetlenebilir:
- Sodyum kromat (Na2CrO4)
- Sodyum fosfat (Na3PO4)
- Sodyum Nitrit (NaNO2)
- Sodyumhexametafosat (Na6P6O18)
- Sodyum Molibdat (Na2MO4)
- Organik fosfonik asidin Çinko tuzları
Biyolojik Üreme Alanı Oluşumu
Evaporatif soğutma kuleleri içeren soğutma suyu sistemleri, patojenler dahil mikroorganizmalar için üreme alanı olabilir. Patojenler Legionella cinsinden bakterileri içerebilir ve soğutma suyuna maruz kalan personel için sağlık ve güvenlik riski oluşturabilir. Mikroorganizmaların büyümesi ayrıca mikrobiyolojik olarak indüklenen korozyon (MIC) yoluyla kurulu ekipmanda hasara veya ısı değişim yüzeylerinin kirlenmesi yoluyla tesis verimliliğinin azalmasına neden olabilir. Soğutma suyu sistemlerinde mikroorganizma büyümesinin sunduğu riskleri yönetmek için tipik olarak biyositler kullanılır. Hidrojen sülfürün bulunduğu jeotermal soğutma suyu sistemlerinde başarıyla kullanılabilecek ticari olarak temin edilebilen biyositlerin seçimi, soğutma suyu kimyası nedeniyle sınırlıdır ve soğutma suyu kalış süresi ile daha da sınırlandırılabilir (doğrudan temaslı kondenserler kullanılıyorsa), sistem tasarımı ve herhangi bir deşarjın çevresel etkisi.
Jeotermal soğutma suyu sistemlerinde hidrojen sülfür ve kükürt bulunması, Thiobacillus ve diğer kükürt metabolize eden bakterilerin kontrolünde zorluklara neden olabilir. Kükürt metabolize eden bakterilerin varlığı, kükürt oksitleyen bakteriler tarafından sülfürik asit üretiminin bir sonucu olarak soğutma suyu sisteminde büyük pH dalgalanmalarına neden olabilir. MRP, soğutma suyu sistemlerinde 2,0’a yaklaşan soğutma suyu pH değerleriyle sonuçlanan, bazı oksitleyici olmayan biyositleri etkisiz hale getiren Thiobacillus’un büyümesini deneyimlemiştir. Thiobacillus’un büyümesinin soğutma suyunun pH’ını düşürdüğü ve karbamat bazlı biyosidi etkisiz hale getirdiği, soğutma suyu sistemi kimyasını tekrar kontrol altına almak için biyositin (glutaraldehide) değiştirilmesinin gerekli olduğu aşikardır.
Kimyasal Hammadde Kullanıımı
Hidroklorik Asit
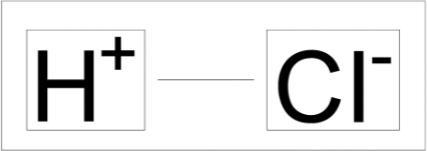
Molekül Formülü (Hidroklorik Asit): HCl
Molekül Ağırlığı: 36,46 g/mol Kimyasal Adı: Hidroklorik Asit CAS Numarası: 7647-01-0
Diğer İsimleri:
- Tuz Ruhu
- Muriatik Asit
- Hidrojen Klorür
- Sulu hidrojen klorür
- Asit
- Klorohidrik Asit
- 7647-01-0
Jeotermal sahada meydana gelen kabuklaşmayı önleme yöntemlerinden biri de Ph ayarlamasıdır. Bu yöntem sayesinde sahada meydana gelen çökelmeler önemli ölçüde önlenir. Bunun için akışkana yeterli miktarda HCl katkısı yapılması gerekir. Teknik olarak önemli bir yöntem olsa da yeterli değildir. 1 L’lik kap içerisinde yer alanda akışkanın 200 ml’lik HCl asit ile çökelmesi sağlanır.
Fiziksel ve Kimyasal Özellikleri:
- Hidroklorik asit, keskin ve tahriş edici bir kokuya sahip renksiz sulu bir sıvıdır.
- Kaynama noktası -85,1 °C dir.
- Erime Noktası -114,2 °C dir.
- O°C’ de su içerisindeki çözünürlüğü 82.3 g/100 g su’dur.
- Su, etanol, metil alkol ve eter içinde çözünmektedir. Hidroklorik asit’in çözünürlüğü sıcaklık arttıkça azalmaktadır.
- Yoğunluğu 1.639 g/L dir.
- Isıtılması durumunda ayrışarak Klor gazı yaymaktadır.
- Bazlarla hızlı bir şekilde ekzotermik reaksiyon verir.
Üretimi:
Bu kimyasalın endüstriyel olarak üretiminde ilk olarak hidrojen klorür elektroliz işlemi ile üretilmektedir. Üretimde hidrojen ve klor elektroliz ile sulu bir çözeltide birleştirilerek elde edilir. Üretim sürecindeki reaksiyon ekzotermik bir reaksiyondur. Bunun için üretim tesisinde bir fırın veya brülör bulunmaktadır. Elde edilen hidrojen klorür gazı saf su içerisinde çözündürülerek tuz ruhu elde edilir. Bunun sonucunda saf olarak elde edilir.
Kimya endüstrisinde en yaygın üretimi, klorinasyon üretim sürecinde yan ürün olarak elde edilmesidir. Sodyum hipoklorit üretimi sırasında klorlama reaksiyonunun yan ürünü olarak üretilmektedir. Klorlama işleminden ayrıldıktan sonra, hidrojen klorür içeren gaz akımı, hidrojen klorür buharlarının zayıf bir hidroklorik asit çözeltisine emilmesiyle konsantre sıvı hidroklorik asidin üretildiği absorpsiyon kolonuna ilerler. Hidrojen klorür içermeyen klorlama gazları daha sonraki işlemler için uzaklaştırılır. Sıvı asit daha sonra ya satılır ya da tesisin başka bir yerinde kullanılır. Nihai gaz akımı, havalandırmadan önce kalan hidrojen klorürü çıkarmak için bir yıkayıcıya gönderilir.
Teflon, polivinil klorür, perkloretilen gibi yaygın olan organik kimyasallar’ın üretimi sırasında meydana gelmektedir.
Sitrik Asit Monohidrat
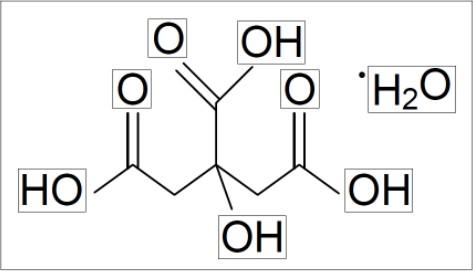
Molekül Formülü (Sitrik Asit Monohidrat): C6H8O7.H20
Molekül Ağırlığı: 210.1 g/mol Kimyasal Adı: Sitrik Asit Monohidrat CAS Numarası: 5949-29-1
Diğer İsimleri:
- Sitrat
- Sitrik Asit Tuzu
- Sitrik Asit Esteri
- 2-hidroksipropan-1,2,3-trikarboksilik asit,hidrat
- 5949-29-1
- Sitrat
- Sitrik Asit Hidrat
- 1,2,3-Propanetrikarboksilik Asit, 2-hidroksi-, monohidrat
Sitrik Asit, oluşan kabuklaşmayı temizlemek için kullanılır. Mekanik temizleme yöntemlerinden bir tanesidir. Periyodik olarak bu işlemin uygulanması gerekir.
Fiziksel ve Kimyasal Özellikleri:
- Sitrik Asit Monohidrat Fiziksel ve Kimyasal Özellikleri Nelerdir?
- Monohidrat yoğunluğu 1.542 g/cm3.
- Parlama noktası 100 °C
- Erime noktası 135 °C dir.
- Beyaz renkli kum kıvamında bir görünüme sahiptir.
- Sitrik Asit Monohidrat suda iyi bir çözünürlüğe sahiptir. Kararlı bir kimyasaldır. Bazlar, güçlü oksitleyici ajanlar, indirgeyici ajanlar ve metal nitratlar ile reaksiyona girmez.
- 25 °C de 1-2 arasında pH değerine sahiptir. Kokusuz bir bileşiktir.
- Renksiz kristaller halinde veya kuvvetli asidik tada sahip beyaz renkli kristal toz olarak görünür.
- Sitrik Asit Monohidrat biyolojik olarak tamamen parçalanabilir. Bu kimyasalın en önemli özellikleri arasındadır.
Üretimi:
Sitrik Asit Monohidrat üretimi Biyokimya ve Biyoteknoloji alanına girmektedir. Sitrik asit, turunçgil meyveleri, armutlar ve ananaslar gibi meyvelerde doğal olarak bulunan ve kalsiyum sitrat kimyasalı gibi kristal yapıda oluşan trikarboksolik asit döngüsündeki ara organik bir kimyasal bileşiktir. Sitrik Asit, limon suyundan elde edilen 6 karbonlu bir trikarboksilik asittir. Organik bir karboksilik asittir ve filtrasyon yöntemi kullanılarak, çözünmeyen bir yapıda çökelti olan Kalsiyum Sitrat oluşturmak için, Kalsiyum Oksit(kireç) kullanılarak narenciye meyve sularından ayrılır. Sülfürik asit ilavesi ile kalsiyum tuzundan alınır. Sitrik Asit üretimi esas itibari ile fermantasyon gerçekleştirilir. Fermantasyon ile sitrik asit üretimi yapabilen birçok maya, mantar ve bakteri gibi mikroorganizma vardır. Sitrik Asit monohidrat, bazı özel kalıp ile glikozun fermantasyonu ile de üretilebilir. Sitrik Asit üretimi için kullanılan 3 farklı yöntem vardır. Bunlardan 2 tanesi çok yaygın kullanılır. Kullanılan yöntemlerden 1 tanesi, sıvı yüzey kültürü 2. ise batık kültür fermantasyonu. Sitrik Asit üretimindeki 2. Yöntem çok yaygındır. Sitrik Asit üretiminde kullanılan bu yöntemler çok basittir. Üretimde kimyasal sentez mantar fermantasyonundan daha ucuz ve az maliyetli değildir.
Aminotris (Metilen Fosfonik Asit)
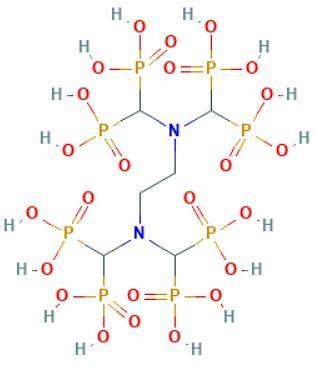
Molekül Formülü: C3H12NO19P3
Molekül Ağırlığı: 299.05 g/mol
Kimyasal Adı: Aminotris (Metilen Fosfonik Asit)
CAS Numarası: 6419-19-8
Diğer İsimleri:
- Aminotris (Methylene Phosphonic Acid) (Atmp)
- Nitrilotrimetanefosfonik Asit
- Nitrilotri (Metilofonfonik Asit)
- Nıtrılotrıs (Methilenfoshonphonik Asit)
- Nıtrılotrıs (Metılen)
Kabuklaşma önleyici yöntemlerinden biri olan inhibitörlü sistemlerde uygulanır. Kuyularda gerekli derinliklere enjekte edilmektedir. Önerilen kullanım miktarı %38-42’dir.
Fiziksel ve Kimyasal Özellikleri:
- Erime noktası 215 ° C’dir.
- Yoğunluğu 25 g / mL’dir.
- Bazlarla uyumlu değildir.
- Endüstriyel su arıtma ve deterjanlar gibi çeşitli endüstriyel uygulamalarda kullanılan etkili bir kireç önleyicidir.
- Çinko ve diğer fosfatların varlığında iyi korozyon önleme özellikleri gösterir.
- ATMP, tekstil endüstrisinde şelatlama maddesi olarak da kullanılabilir.
Maleik Anhidrit
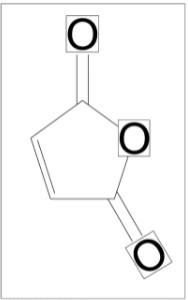
Molekül Formülü (Maleik Anhidrit): C4H2O3
Molekül Ağırlığı: 98.057 gr/mol Kimyasal Adı: Maleik Anhidrit CAS Numarası: 108-31-6
Diğer İsimleri:
- 2,5-Furandion
- Toksik Anhidrit
- Maleik Asit Anhidrit
- Polimaleik Anhidrit
- MA Oligomeri
- MA Polimer
- Poli (MA)
- Polimaleik Anhidrit
- Maleik Asit Anhidrit Homopolimeri
- Polimerler
Maleik asitin asit anhidriti olarak sınıflandırılan organik kimyasal maddedir. Çok yönlü bir kimyasal bileşiktir.Asit Anhidritler fonksiyonel gruplardır. Su ile çok kolay reaksiyona girerek maleik asit oluşturmaktadır. Bu nedenle piyasada maleik asit satışı yapılmamaktadır.
Maleik Asit, kabuklaşma önleyici olarak inhibitör enjeksiyon yönteminde kullanımı söz konusudur. 1-5% olarak kullanımı söz konusudur. Kuyularda gerekli derinliklere enjekte edilmektedir.
Fiziksel ve Kimyasal Özellikleri:
- Renksiz kristal formda iğne, pul, topak, çubuk, briket veya kaynaşmış kütle durumundadır.
- Koku olarak tahriş edici ve boğucu özelliğe sahiptir. Keskin bir kokusu vardır.
- Kaynama noktası 202 °C dir.
- Erime noktası 53 °C dir.
- Çözünürlüğü incelendiğinde su içerisinde çok iyi çözünürlüğe sahiptir. Örneğin su içerisinde 25 °C de 79 g/ 100 mlt olarak görülmektedir. Maleik Anhidrit çözünürlük olarak sıcak solvent içerisinde iyi çözünmektedir. Bunun yanında aşağıdaki kimyasallarda iyi çözünmektedir.
- Aseton
- Kloroform
- Etil Asetat
- Benzen
- Toluen
- O-ksilen
- Karbon Tetraklorür
- Dioksan
- Yoğunluğu 1.48 g/cm3 tür.
- Parlama noktası 102°C dir.
ÜRETİMİ:
Maleik Anhidrit üretimi dehidrasyon sentezi ile gerçekleşmektedir. 2 tane karboksilik Asidin bir araya gelmesi sonucunda aralarındaki reaksiyon sonucunda bir su molekülünün çıktığı görülür. Bu reaksiyon sonucunda oluşmaktadır. Yani Maleik Asitten dehidrasyon yöntemi ile su çıkışı sağlandığında MA üretimi gerçekleşmiş olur. Bunun yanında MA için birkaç farklı üretim yöntemi mevcuttur. Maleik Asit ve P2O5 in düşük basınç altında süblime edilmesi ile hazırlanabilir. Benzen veya diğer uygun hidrokarbonların katalitik buhar faz oksidasyonları ile ticari üretim gerçekleştirilebilir. Burada Benzenin atmosferik oksijen ile 400 °C de V2O5 katalizörü yardımı ile gerçekleştirilen buhar faz oksidasyonudur. Yan ürün olarak Ftalik Anhidritten gelen o-ksilen dir.
Sodyum Molibdat
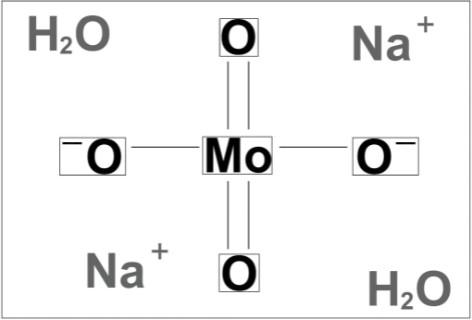
Molekül Formülü (Sodyum Molibdat): Na2MoO4
Molekül Ağırlığı: 205.9 g/mol Kimyasal Adı: Sodyum Molibdat CAS Numarası: 7631-95-0
Diğer İsimleri:
- Disodyum Molibdat
- 7631-35-0
- Molibdik Asit
- Molibdik Asit, disodyum tuzu
- Sodyum Molibden Oksit
- Disodyum Tetraokso Molibdat
- Susuz Form
- Dihidrat Form
Jeotermal santrallerde korozyon inhibitörü olarak yaygın bir kullanıma sahiptir. Belli bir ortam içinde bulunan bir metalik sistemin korozyonunu önlemek veya korozyon hızını azaltmak amacıyla kullanılmaktadır.
Fiziksel ve Kimyasal Özellikleri:
- Fiziksel görünüm olarak beyaz toz formundadır.
- Erime Noktası 687 °C dir.
- Yoğunluğu 3.78 gr/cm3 tür.
- Sudaki çözünürlüğü 100 °C de 84 gr/100 mlt dir.
- Isıtılması durumunda zehirli formdaki sodyum oksit ile birlikte dumanlar yayar. Halojenlerin bulunduğu ortamda şiddetli reaksiyona girmektedir. Buna göre Hidroklorik asit ve sodyum hipoklorit varlığında patlama ve yangın tehlikesi oluşturur.
- Normal şartlar altında yanıcı maddedir. Magnezyum varlığında patlama yapmaktadır.
ÜRETİMİ:
Sodyum Molibdat üretiminde 2 farklı yöntem uygulanır.
- Yöntem Kavurma Yöntemidir;
Bu üretim yönteminde ilk olarak molibden kimyasalı yüksek ısıda kavrulur. Bu sayede molibden trioksit oluşturulur. Daha sonraki süreçte Sıvı kostik ile yıkama yapılır ve çözelti form elde edilir. Bu süreçte sırası ile süzme, buharlaştırma işlemi yapılır. Daha sonra soğutma, kristalleştirme, ayırma ve 70-80 °C de kurutma yapılarak konsantre ürün elde edilir.
- Yöntem Yeniden Kristalleştirme Yöntemidir;
Bu yöntem ile daha yüksek sağlığa sahip hammadde elde edilebilir. Tekrar kristalleştirme işlemi gerçekleştirildikten sonra suda çözündürülür. Çökeltme işlemini gerçekleştirmek için nitrik asit eklenmesi gerekmektedir. Bu sayede çökeltme işlemi gerçekleştirilir.
Daha sonra yıkanıp kurutulur. Ve 700 °C süblimasyon ile yüksek saflıkta molibden trioksit elde
edilir. Sodyum hidroksit çözeltisi eklendikten sonra 70-80 °C de kurutulur ve soğutulur. Ve sonunda sodyum molibdat dihidrat elde edilir.
Sodyum Kromat
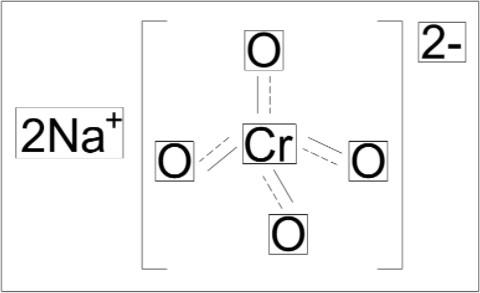
Molekül Formülü (Sodyum Kromat): Na2CrO4
Molekül Ağırlığı: 161.972 gr/mol Kimyasal Adı: Sodyum Kromat CAS Numrası: 7775-11-3
Diğer İsimleri:
- (IV) Değerlikli
- Krom Disodyum Oksit
- Sodada Kromat
- Nötr Form
- Susuz Form
- Krom Sodyum Oksit
- Sodyum Monokromat
- Kromyum Sodyum
Jeotermal santrallerde korozyon inhibitörü olarak yaygın bir kullanıma sahiptir. Belli bir ortam içinde bulunan bir metalik sistemin korozyonunu önlemek veya korozyon hızını azaltmak amacıyla kullanılmaktadır.
Fiziksel ve Kimyasal Özellikleri:
- Sarı kristalimsi katı formda bir kimyasal maddedir. Renk olarak sarı ortofobik kristallerdir.
- Tat olarak acı metalik bir tada sahiptir.
- Erime noktası 762 °C dir.
- Çözünürlük olarak su içerisinde iyi çözünmektedir. 25 °C de 87.6 gr/100 gr su olarak tespit edilmiştir. Metanol ve etanol içerisinde az çözünmektedir.
- Yoğunluğu 2.7 gr/cm3 tür.
- Kararlılık olarak standartlardaki depolama koşullarında kararlı bir kimyasal maddedir.
- Sulu çözeltisi alkali özelliğe sahiptir.
- Oksitleme etkilerinden kaynaklı aşındırıcı kimyasal maddedir.
- Higroskopik yapıdaki formu suyu kolayca emer ve hidratlanmış tuzlarına dönüşmektedir.
- Yanıcı maddelerle yangına sebebiyet verebilecek özelliktedir.
ÜRETİMİ:
Üretiminde Krom Metal cevheri reverberatory fırınında kireç ve soda varlığında hava yardımıyla eritilmektedir. Bu süreçten sonra erimiş suda çözülmektedir. Az miktarda sodyum karbonat eklenir. Daha sonra çözelti dökülmektedir. Sonraki süreçte asetik asit ile asitlik kazandırılır. Konsantre edilir ve kristallendirilir.
Bu Reaksiyon aşağıdaki gibidir;
4Fe (CrO2)2 + 8Na2CO3 + 7O 2 → 8Na2CrO 4 + 2Fe2O 3 + 8CO2
Sodyum Heksametafosfat
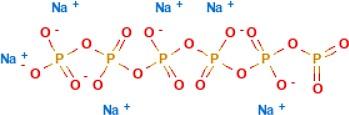
Molekül Formülü (Sodyum Heksametafosfat): Na6O18P6
Molekül Ağırlığı: 611.77 g/mol Kimyasal Adı: Sodyum Heksametafosfat CAS Numarası: 10124-56-8
Diğer İsimleri:
- Sodyum Polifosfalar
- Sodyum Polimetafosfat; SHMP
- Calgon
Jeotermal santrallerde korozyon inhibitörü olarak yaygın bir kullanıma sahiptir. Belli bir ortam içinde bulunan bir metalik sistemin korozyonunu önlemek veya korozyon hızını azaltmak amacıyla kullanılmaktadır.
Fiziksel ve Kimyasal Özellikleri:
- Erime noktası 616 °C dir.
- Kaynama noktası 1500℃ dir.
- Yoğunluğu 2.181 dir.
- Su içerisinde çözünürken, organik solventler içerisinde çözünmez.
- Beyaz, katı formda bir görünüme sahiptir.
- SHMP, ayırıcı olarak kullanılır ve E numarası E452i altında kullanıldığı bir gıda katkı maddesi de dahil olmak üzere çok çeşitli endüstrilerde uygulamalara sahiptir.
- Ph’ı 8,0-8,6’ya yükseltmek için bazen SHMP’ye sodyum karbonat eklenir, bu da su yumuşatma ve deterjanlar için kullanılan bir dizi SHMP ürünü üretir.
- Sodyum heksametafosfatın önemli bir kullanımı, kil bazlı seramik parçacıklarının üretiminde bir deflokülant olarak kullanılmasıdır. Aynı zamanda, toprak dokusu değerlendirmesi için kil ve diğer toprak tiplerini parçalamak için bir dağıtıcı ajan olarak da kullanılır.
- Diş macunlarında leke önleyici ve diş taşı önleyici bir bileşen olarak aktif madde olarak kullanılır.
ÜRETİMİ
Sodyum dihidrojen fosfat: Soda çözeltisi önce 2 saat boyunca 80~100 ℃’de fosfat asit ile nötralizasyon reaksiyonuna tabi tutuldu; elde edilen sodyum dihidrojen fosfat solüsyonu buharlaştırma yoluyla konsantre edildi, soğutuldu ve sodyum dihidrojen fosfat dihidrat elde etmek üzere kristalleştirildi ve iki kristal suyu çıkarmak için 110~230°C’ye ısıtıldı; ayrıca yapısal suyu çıkarmak için ısıtmaya tabi tutulur; ayrıca erimiş sodyum metafosfatla sonuçlanacak dehidrasyon için 620°C’ye ısıtılır ve ayrıca sodyum heksametafosfata polimerize edilir ve boşaltılır; pullanma için 650 ℃ ila 60~80 ℃ arasında soğutma şoku uygulayın ve heksametafosfat ürünlerini elde etmek için ezin. Reaksiyon formülü aşağıdaki gibidir:
Na2CO3 + 2H3PO4 + H2O → 2NaH2PO4•2H2O + CO2 ↑ NaH2PO4•2H2O [△] → Na2H2PO4 + 2H2O
2NaH2PO4 [△] → Na2H2P2O7 + H2O Na2H2P2O7 → 2NaPO3 + H2O 6NaPO3 [△] → (NaPO3)6
Fosfor pentoksit yöntemi: yanma ve oksidasyon için sarı fosforu kuru hava buharına koyun, soğutmadan elde edilen fosfor pentoksit soda ile belirli oranda karıştırılır (Na2O: P2O5 = 1~1.1). Karışık tozu bir grafit potaya koyun ve kurutulması ve topaklaşması için dolaylı olarak ısıtılır, elde edilen sodyum heksametafosfat, soğutma şoku üzerine dökülmeye maruz kalır ve endüstriyel heksametafosfat ürünleri elde etmek için toz haline getirilir. Reaksiyon formülü aşağıdaki gibidir:
P4 + 5O2 → 2P2O5
P2O5 + Na2CO3 → 2NaPO3 + CO2 ↑ 6NaPO3 [△] → (NaPO3) 6
Glutaraldehit

Molekül Formülü (Glutaraldehit): C5H8O2
Molekül Ağırlığı: 100.12 g/mol Kimyasal Adı: Glutaraldehit CAS Numarası: 111-30-8
Diğer İsimleri:
- Gludesin
- Glutaral
- Glutaraldehit
- Glutardialdehit
- Glutarol
- Korsolex
Evaporatif soğutma kuleleri içeren soğutma suyu sistemleri, patojenler dahil mikroorganizmalar için üreme alanı olabilir. Akışkanda yer alan mikroorganizmalara bağlı olarak doğru biyositini seçmek önem taşımaktadır. Burada dikkat edilmesi gereken diğer bir konu, seçilen biyositin pH dalgalanmasına yol açmamasıdır. Mikroorganizmaların büyümesi ayrıca mikrobiyolojik olarak indüklenen korozyon (MIC) yoluyla kurulu ekipmanda hasara veya ısı değişim yüzeylerinin kirlenmesi yoluyla tesis verimliliğinin azalmasına neden olabilir. Soğutma suyu sistemlerinde mikroorganizma büyümesinin sunduğu riskleri yönetmek için tipik olarak biyositler kullanılır. Soğutma suyunun içeriği dikkate alınarak Glutaraldehit biyositini seçilmesi tercih edilmektedir.
Fiziksel ve Kimyasal Özellikleri:
- Erime noktası -15 °C dir.
- Kaynama noktası 100 °C dir.
- Yoğunluğu 20 °C’de 1.058 g/mL dir.
- Açık sarı bir sıvıdır. Keskin bir kokuya sahiptir.
- Su ile karışır. Etanol, benzen, eter içinde çözünür.
- Kendiliğinden tutuşma sıcaklığı 225 °C dir.
- Glutaraldehit, güçlü oksitleyiciler ve güçlü bazlarla uyumsuz olabilir.
- Tıbbi ve dişçilik ekipmanlarını dezenfekte etmek için kullanılır. Ayrıca endüstriyel su arıtma ve koruyucu olarak kullanılır.
ÜRETİMİ
Glutaraldehit, endüstriyel olarak siklopentenin oksidasyonu ile üretilir. Alternatif olarak, akrolein ve vinil eterlerin Diels-Alder reaksiyonu ve ardından hidroliz ile yapılabilir. Diğer birçok dialdehit (örneğin glioksal) ve basit aldehitler (örneğin formaldehit) gibi glutaraldehit de sulu çözelti içinde çeşitli hidratlara dönüşür ve bunlar da diğer dengeleyici türlere dönüşür. Monomerik glutaraldehit, aldol kondenzasyon reaksiyonu ile polimerleşir ve alfa, beta-doymamış poli-glutaraldehit verir. Bu reaksiyon genellikle alkali pH değerlerinde meydana gelir.





Son Yorumlar